细胞培养肉
细胞培养肉简介
细胞培养肉是通过动物细胞体外培养和生物制造而生产的供人类食用的肉的组织,也被称为“人造肉”、“细胞肉”和“清洁肉”等。一般生产过程如图,首先从活的或者处死的动物组织中获取合适的种子细胞,对种子细胞进行小规模扩增培养保持其干性生长,接着投入到生物反应器中进行扩大的规模化生产,然后根据需求将干细胞进行定向诱导谱系分化,最后将细胞与合适的支架材料结合进行三维立体培养或结合3D打印技术,最终获得成熟的肉制品。
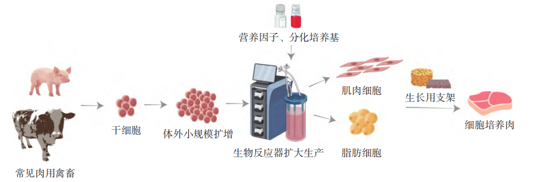
细胞培养肉一般生产流程图
细胞培养肉关键技术
● 种子细胞的选择
随着科学技术发展及培养肉规模化生产,对细胞培养肉种子细胞的主要要求为:①种子细胞能够在体外持续增殖,细胞的基因组要相对稳定,形成生产用细胞系;②在大规模培养过程中,细胞能较好地抵抗剪切力,并能够分化产生肌肉、脂肪或者基质蛋白其中的一种或多种。
可用于细胞培养肉生产的干细胞有很多,主要包括胚胎干细胞(Embryonic stem cells,ESCs)、诱导多能干细胞(Induced pluripotent stem cells,iPSCs),以及成体干细胞,如肌肉干细胞(Muscle stem cells,MuSCs)和间充质干细胞(Mesenchymal stem cells,MSCs)。
可应用于细胞培养肉的种子细胞

● 种子细胞的获取方法
细胞培养肉种子细胞的获取一般需要纯化过程,如肌肉干细胞一般可利用预贴壁法纯化,也可以通过肌肉干细胞表面标志物采用流式细胞仪分选出高纯度的肌肉干细胞。
● 种子细胞功能的维持
在细胞培养技术的研究领域,深入剖析细胞的生长过程及其环境的动态变化对于推动该技术的创新具有极其重要的理论价值。随着对培养肉种子细胞研究的深入,单细胞转录组学技术的应用使得科学家能够揭示细胞群体内的异质性和分化路径。通过单细胞RNA测序技术,研究人员能够识别干细胞的不同亚群,并探索这些亚群的转录调控网络以及它们如何决定细胞的命运。
尽管成体干细胞易于获取且具备分化为肉类组织所需成熟细胞类型的潜力,但体外培养过程中不可避免地遭遇Hayflick极限,限制了其长期增殖与分化能力的维持。为应对培养肉种子细胞功能衰退的挑战,科研人员致力于解析功能下降的内在机制,旨在通过干预手段延缓此过程。干细胞的功能受复杂的调控网络控制,包括转录因子、表观遗传修饰、相关信号通路的调控以及微环境效应。因此,研究者希望通过调控干细胞各方面的功能特征,延缓细胞在体外的功能衰退。
基因编辑技术作为一种革命性的生物工具,为细胞系的开发和研究提供了新的方向。它被用于开发能够持续增殖并保持分化能力的种子细胞系,以寻找更优的种子细胞。基因编辑技术允许科学家精确地修改细胞内的基因序列,从而增强或抑制特定的细胞功能。这为研究人员提供了一种快速、高效且精确的方法来培育具有特定特性的细胞系。然而,在培养肉种子细胞的过程中,基因编辑技术也面临着挑战,包括编辑的效率和精确性。此外,基因编辑可能会带来一些副作用和安全风险,这需要进行全面的安全性评估。同时,伦理和道德问题也是在应用基因编辑技术时必须考虑的重要因素。
● 种子细胞的扩增培养
(1)无血清培养技术
培养基在细胞培养肉的生产中扮演着至关重要的角色,它相当于细胞的“营养餐”,为种子细胞的增殖、分化等过程提供必要的营养,并维持特定的细胞命运过程。然而,传统上使用的血清大多来源于动物,存在批次间质量不稳定、容易受到供体病毒的污染的问题,对细胞培养肉的生产构成了重大挑战。因此,开发无血清培养基,甚至是化学成分完全明确的培养基,成为了培养肉技术发展的关键。这种培养基的开发有助于培养基的标准化生产。通过对相关成分成本进行优化,还能够实现培养基的低成本生产。
无血清培养基经过较长时间的研究,目前有五种主要类型的无血清培养基能够在不依赖动物血清的情况下促进细胞生长:普通无血清培养基、Xeno-free培养基、无动物成分培养基、无蛋白培养基以及化学成分明确培养基。这些培养基的开发旨在使用植物性或合成替代品取代动物源性成分,在细胞培养过程中支持细胞的增殖和功能。
近年来,随着研究的不断深入,细胞培养肉领域在无血清培养基乃至化学成分明确的培养基方面取得了显著进展。研究人员通过基于转录组学和蛋白组学,利用增殖分化的关键因子,建立了猪肌肉干细胞增殖分化无血清培养基配方。还有研究者利用转录组学,根据特定的受体蛋白变化以及关键的通路变化,研制了增殖以及分化的化学成分明确的培养基。基于早期的胚胎干细胞E8的研究成果以及高稳定性的FGF-G3生长因子,研究人员研制了B8培养基,适用于牛肌肉干细胞增殖的无血清增殖培养基。另外,在生长因子的表达上,随着代谢工程和合成生物学的发展,对生长因子的改造使其稳定性有了极大提高,从而减少了生长因子的使用量,提高了生长因子的使用效率,并降低了培养基的整体成本。
(2)种子细胞悬浮培养技术
在细胞培养肉的生产过程中,除了血细胞外,大多数脊椎动物细胞系依赖于贴壁培养,这种培养方式受到可用表面积的限制,从而限制了细胞扩增的潜力。与此相比,悬浮培养技术能够显著提升细胞密度和产量。研究人员正在探索如何将培养肉的种子细胞适应无载体悬浮培养,使其不再依赖于锚定生长。这种驯化过程一旦成功,将使得细胞能够在三维空间中大规模培养,从而实现高效、大规模的细胞收获。当前悬浮培养的方式主要包括;微载体悬浮培养、固定化培养,聚集体悬浮培养以及单细胞悬浮培养等方法。
微载体悬浮细胞培养技术是一种将原本贴壁生长的细胞转化为悬浮生长状态的方法,这一技术在工业规模的生物反应器中具有巨大的规模化生产潜力。通过在培养过程中引入微载体,为细胞提供了必要的附着表面,从而使得细胞能够在悬浮状态下生长,极大的扩大了培养规模。微载体是由多种不同的材料、孔隙度和形态构成的微小颗粒,它们为那些依赖锚定生长的细胞提供了适宜的粘附表面。目前,基于微载体的细胞培养包括三个主要步骤:细胞附着于微载体,细胞增殖,以及从微载体中分离并收获细胞。微载体悬浮培养技术的研究,涉及的领域包括新型材料的开发、微载体表面的改性、微载体物理性能的优化,以及培养参数的调整等。
另一种更为高效的培养方式为细胞无载体悬浮培养,其操作简单,放大方便,成本低,然而,需要前期对细胞进行驯化。悬浮液驯化过程中首先根据对细胞生长和适应期的观察,选择合适的低血清培养基。然后逐渐降低血清浓度培养细胞,直到在低血清或无血清条件下培养的细胞与在高血清条件下培养的细胞在生长和增殖方面没有显著差异。除了传统的细胞驯化方法外,一些研究利用基因工程减少或消除粘附分子的表达,这可能有助于细胞驯化。
(3)生物反应器放大培养
生物反应器是指用于生产生物材料的容器,通常由一个装有叶轮或搅拌器的圆柱形培养容器组成。根据叶轮的配置、速度和容器的几何形状,可以调整剪切力等流体动力特性。同时监测生物反应器的微环境,调整关键参数,以满足细胞培养过程中营养物质交换和扩散的需要。目前常用的生物反应器类型有搅拌式生物反应器、波浪式生物反应器及气升式生物反应器。
(4)组织工程分化
为了充分复制传统肉类的感官特性,培养肉生产需要在体外复制肌肉发育过程。细胞培养肉是将细胞接入材料中,利用细胞自身的分化特性和支架材料特性,最终形成与肉类似营养、质构和风味的终产品。目前,医学领域已经采用了多种三维细胞培养方法,包括细胞球体培养、支架培养和生物打印技术。
1、细胞球体培养
细胞球体培养是指将细胞悬浮在含有特定培养基的容器中,使相邻细胞在三维空间中自由聚集,形成球形结构的培养方法。该方法不需要支架或载体,易于操作和维持。球体培养需要高度控制的环境,包括特定的培养基和温度,以确保细胞生长。此外,球形培养成本较高,不适合大规模养殖肉制品生产。细胞球体的形成是一个复杂的过程,通常需要优化培养条件和细胞密度,以促进细胞的自组织和聚集。
2、细胞支架培养
细胞支架培养是指将细胞植入支架上,通过模拟肌肉的物理结构及其在三维空间中的相互作用,实现三维细胞培养的培养方法。在培养肉研究的背景下,使用多孔三维结构的支架,模拟细胞外基质,促进肌肉细胞、脂肪细胞和结缔组织细胞的基本粘附、增殖和分化。理想的细胞支架应具有良好的生物相容性、较大的生长和粘附表面积、适当的机械强度等适合细胞生长的特性。此外,支架应当易于与细胞分离,或能够直接作为培养肉产品的最终组成部分,在培养过程中保持其结构的稳定性。在支架材料方面,目前适用于培养肉工业化生产的主要支架类型是多孔支架和水凝胶支架。支架材料应来源于植物或者微生物的多糖和蛋白类的材料,如大豆蛋白、玉米蛋白、海藻酸、纤维素等。其结构仿真是该领域技术难点之一。
3、3D生物打印
3D 生物打印是利用3D生物打印机的挤压式打印模式,将含细胞和非细胞成分的生物墨水精确定位和分布并构建复杂的三维(3D)功能组织,经过长时间培养形成培养肉的塑形方式。在细胞培养肉领域,3D打印可以调节人造肉产品中蛋白质、脂肪和其他营养物质的产生,在提供更逼真的肉类结构的同时提供定制产品。

 首页
首页
 项目介绍
项目介绍
 生鲜肉
生鲜肉
 加工肉
加工肉
 副产品
副产品
 未来肉制品
未来肉制品
